24 de junio de 2023 - Shelly Jones
Versión actualizada - 2 de enero de 2025
Loading...
Comparte este artículo en las redes sociales.
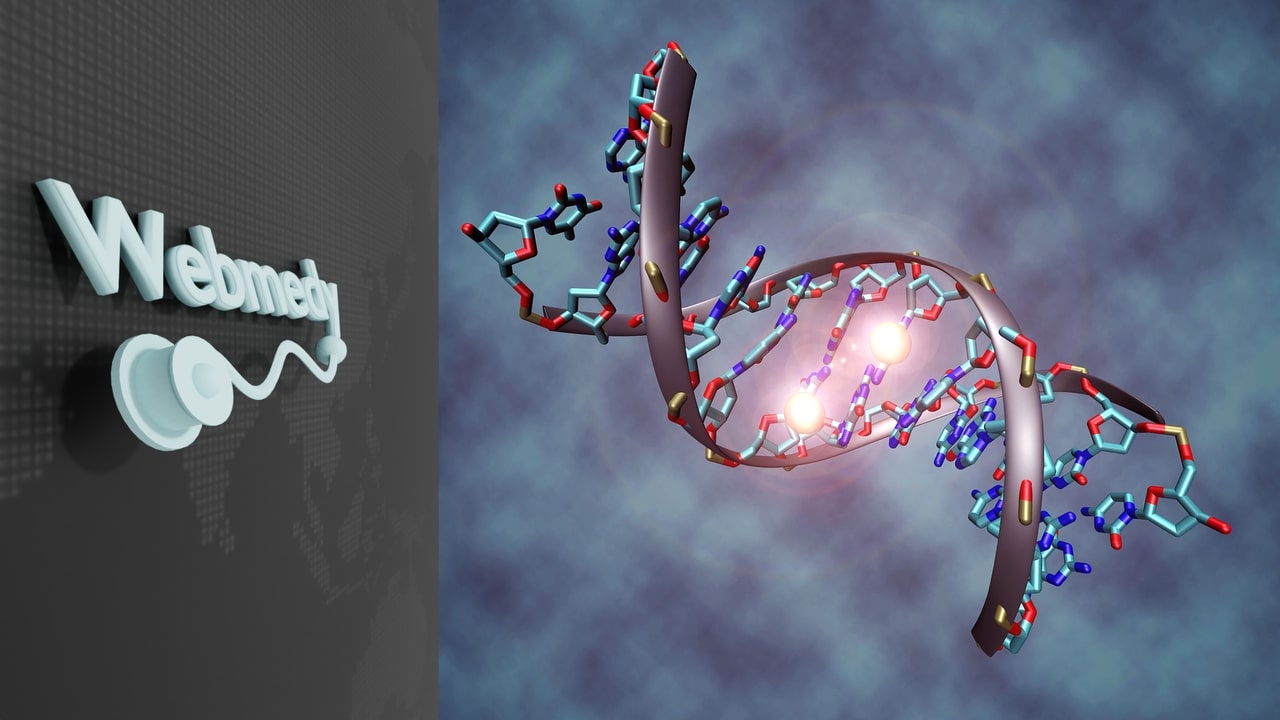
El campo de la genética ha avanzado mucho en nuestra comprensión de la vida, la enfermedad y la salud. Sin embargo, la genética solo forma parte del rompecabezas. La epigenética ha ganado reconocimiento recientemente por su importante papel en varios procesos biológicos, incluido el inicio y la progresión de la enfermedad. Al descubrir cómo nuestro epigenoma interactúa con nuestro código genético y el medio ambiente, esperamos arrojar luz sobre cómo este conocimiento podría transformar el diagnóstico, el pronóstico y el tratamiento del cáncer.
La epigenética se refiere a los cambios en la expresión génica que no implican alteraciones en la secuencia de ADN subyacente. Los cambios epigenéticos son normales y naturales. A menudo están influenciados por la edad, el medio ambiente, el estilo de vida y el estado de la enfermedad. Pueden conducir a cambios específicos en el cuerpo, como células que se desarrollan en un hígado, cerebro o células de la piel, aunque todas tengan el mismo ADN.
Los cambios epigenéticos son modificaciones que afectan la expresión génica sin alterar la secuencia de ADN subyacente. Estos cambios, a diferencia de los cambios genéticos (mutaciones), no implican un cambio en la secuencia de nucleótidos del ADN. En cambio, afectan la forma en que las células leen los genes.
Piense en los cambios genéticos como alteraciones en las palabras de un libro, alterando la historia fundamental. Los cambios epigenéticos, por otro lado, pueden verse como notas al margen del libro. No cambian las palabras, pero afectan cómo se interpretan y, por lo tanto, cómo se entiende la historia.
Esta es la modificación epigenética más estudiada. Implica la adición de un grupo metilo (un átomo de carbono unido a tres átomos de hidrógeno, CH3) a la molécula de ADN, generalmente en una citosina seguida de una guanina, un lugar conocido como sitio CpG. Cuando los grupos metilo se unen a un punto particular en un gen, pueden evitar que el gen se exprese.
El ADN de las células está envuelto alrededor de proteínas llamadas histonas. Juntos, forman una estructura llamada cromatina. La forma en que se envuelve el ADN puede afectar si la célula puede leer los genes. Si la cromatina está abierta y suelta, puede ocurrir la expresión génica. Si está apretado, puede prevenir la expresión génica. Las modificaciones de las histonas, como la acetilación, la metilación y la fosforilación, pueden cambiar la forma de la cromatina y, por lo tanto, regular la expresión génica.
Aunque estas moléculas no codifican proteínas, juegan un papel importante en el control de la expresión génica. Uno de los tipos de ncRNA más estudiados es el microRNA (miRNA), pequeñas hebras de RNA que pueden unirse a los RNA mensajeros (mRNA), evitar que produzcan proteínas y, por lo tanto, influir en la expresión génica. Otros tipos de ncRNA pueden influir en la forma en que se estructura la cromatina, controlando así qué genes son accesibles para la expresión.
La metilación normalmente actúa para reprimir la transcripción de genes. Cuando un gen es silenciado por la metilación, es como poner un cartel de no molestar en una puerta. La maquinaria necesaria para leer el gen recibe la señal de no proceder y, por lo tanto, la proteína del gen no se produce.
Las modificaciones de las histonas pueden fomentar o desalentar la expresión génica. Por ejemplo, la acetilación de histonas a menudo afloja el ADN y hace que los genes sean más accesibles para la transcripción, promoviendo la expresión génica. Por el contrario, ciertos tipos de metilación de histonas pueden conducir a cromatina cerrada y condensada, lo que puede prevenir la expresión génica.
Estas moléculas, en particular los microARN, pueden unirse a los ARN mensajeros y evitar que se traduzcan en proteínas, actuando así como poderosos represores de la expresión génica. Otros ncRNA pueden reclutar proteínas que modifican la estructura de la cromatina, haciendo que los genes sean más o menos accesibles para la expresión.
Es importante tener en cuenta que estos procesos a menudo no actúan de forma independiente. Pueden interactuar e influirse mutuamente en una compleja red de regulación. Comprender estas modificaciones epigenéticas y su interacción es esencial para apreciar cómo se controla la expresión génica y cómo la desregulación de estos procesos puede contribuir a enfermedades como el cáncer.
Las modificaciones epigenéticas juegan un papel crucial en la expresión génica. Cuando estas modificaciones se vuelven anormales o inapropiadas, pueden alterar el funcionamiento normal de las células y conducir potencialmente al desarrollo de cáncer. Esta interrupción puede ocurrir de varias maneras:
Los genes supresores de tumores son cruciales para mantener bajo control la división celular. Cuando se produce hipermetilación en la región promotora de estos genes, puede apagarlos, eliminando así su efecto inhibidor sobre la proliferación celular. Esto puede resultar en un crecimiento celular descontrolado, una característica del cáncer.
La hipometilación puede activar genes que promueven el crecimiento celular, conocidos como oncogenes. Cuando estos genes se activan en exceso, pueden conducir a una división celular acelerada que conduce al cáncer.
Las modificaciones aberrantes de las histonas pueden alterar la estructura de la cromatina y provocar la activación inapropiada o el silenciamiento de los genes.
Los ARN no codificantes, como los miARN, también juegan un papel en el cáncer. Algunos miARN, conocidos como onco-miR, pueden promover el cáncer cuando se sobreexpresan. Otros, conocidos como miARN supresores de tumores, pueden prevenir el cáncer. Pero cuando se reduce su expresión, puede conducir a la progresión del cáncer.
Casi todos los tipos de cáncer se han relacionado hasta cierto punto con cambios epigenéticos. Por ejemplo:
La hipermetilación del ADN a menudo ocurre en el cáncer de mama, silenciando ciertos genes supresores de tumores.
Los patrones de metilación anormales, incluida la hipometilación global y la hipermetilación de genes específicos, están asociados con el cáncer colorrectal.
Tanto la metilación del ADN como los cambios en la modificación de las histonas se observan con frecuencia en el cáncer de pulmón.
Los cambios en la metilación del ADN y las modificaciones de las histonas están relacionados con varios tipos de leucemia. Además, ciertos tipos de leucemia están asociados con mutaciones en enzimas que agregan o eliminan estas marcas epigenéticas.
Los cambios epigenéticos, especialmente la metilación del ADN, están asociados con el desarrollo y la progresión del cáncer de próstata.
Se sabe que los factores ambientales y de estilo de vida influyen en las modificaciones epigenéticas, que pueden contribuir potencialmente al desarrollo del cáncer.
La exposición al humo del tabaco puede provocar cambios en la metilación del ADN que silencian los genes supresores de tumores.
Ciertos nutrientes pueden afectar los procesos epigenéticos. Por ejemplo, el folato, un tipo de vitamina B, es fundamental para producir y mantener las células. También es necesario para el proceso de metilación. Una dieta baja en folato puede conducir a la hipometilación del ADN, lo que podría contribuir al cáncer.
El consumo prolongado de alcohol puede conducir a patrones anormales de metilación del ADN, lo que podría contribuir al cáncer.
La exposición a ciertas toxinas ambientales, como el asbesto, puede provocar cambios epigenéticos relacionados con el cáncer de pulmón y el mesotelioma.
El envejecimiento está asociado con cambios en el panorama epigenético, incluidas alteraciones en la metilación del ADN, modificaciones de histonas y expresión de miARN. Estos cambios pueden contribuir al desarrollo del cáncer.
Un biomarcador es un indicador medible de la gravedad o presencia de algún estado de enfermedad. Los cambios epigenéticos, como los patrones de metilación del ADN y las modificaciones de las histonas, pueden ser específicos de ciertos tipos de cáncer y, por lo tanto, servir como biomarcadores potenciales.
Por ejemplo, la metilación de ciertos genes puede indicar la presencia de tipos específicos de cáncer. De manera similar, los cambios en los niveles de ciertos ARN no codificantes (como los microARN) en la sangre u otros fluidos corporales también pueden actuar como biomarcadores potenciales del cáncer. Debido a que estos cambios a menudo ocurren temprano en la progresión de la enfermedad, pueden ser herramientas valiosas para la detección temprana del cáncer, a veces incluso antes de que aparezcan los síntomas.
La terapia epigenética implica el uso de medicamentos u otras medidas para corregir las modificaciones epigenéticas que contribuyen al cáncer. A diferencia de los tratamientos contra el cáncer tradicionales que tienen como objetivo matar las células cancerosas directamente, las terapias epigenéticas tienen como objetivo reprogramar las células cancerosas revirtiendo las marcas epigenéticas anormales, restaurando así el control normal de la expresión génica.
Uno de los aspectos atractivos de abordar los cambios epigenéticos es que, a diferencia de los cambios genéticos, son potencialmente reversibles. Esto abre una nueva vía para el tratamiento del cáncer, en la que los interruptores defectuosos que contribuyen al cáncer pueden restablecerse, lo que ofrece la esperanza de tratamientos más efectivos.
Ya se han aprobado varios medicamentos epigenéticos para el tratamiento del cáncer, y muchos más se están probando en ensayos clínicos:
Los medicamentos como la azacitidina y la decitabina inhiben las ADN metiltransferasas, las enzimas responsables de agregar grupos metilo al ADN. Al hacerlo, pueden revertir la hipermetilación, lo que podría activar genes supresores de tumores. Estos medicamentos están aprobados para su uso en el síndrome mielodisplásico, un trastorno de la médula ósea que puede provocar leucemia.
Fármacos como el vorinostat y la romidepsina inhiben las histonas desacetilasas, enzimas que eliminan los grupos acetilo de las histonas. Esto puede conducir a una estructura de cromatina más abierta, lo que podría permitir la reexpresión de genes silenciados. Estos medicamentos se usan en el linfoma cutáneo de células T.
Estos fármacos, que aún se encuentran en las primeras etapas de desarrollo, inhiben las proteínas que reconocen las histonas acetiladas. Se han mostrado prometedores en ciertos tipos de leucemia y tumores sólidos.
Si bien aún se encuentran en gran parte en etapas experimentales, se están desarrollando y probando terapias diseñadas para modular los niveles de miRNA específicos u otros ncRNA.
Varios avances recientes han ampliado nuestra comprensión del papel de la epigenética en el cáncer:
Los avances en las tecnologías de secuenciación han permitido realizar un mapeo detallado del epigenoma, lo que ha llevado al descubrimiento de modificaciones epigenéticas novedosas y sus funciones en el cáncer.
Al examinar los epigenomas de células individuales, los investigadores pueden comprender cómo la heterogeneidad epigenética dentro de un tumor podría impulsar la progresión del cáncer y afectar la respuesta al tratamiento.
Esta innovadora técnica permite la detección del ADN tumoral circulante (ctDNA) en el torrente sanguíneo, que porta las alteraciones epigenéticas encontradas en el tumor. Muestra potencial para la detección no invasiva del cáncer, el seguimiento de la progresión de la enfermedad y la orientación de las decisiones de tratamiento.
La epigenética está preparada para desempeñar un papel clave en el floreciente campo de la medicina personalizada. Al comprender los cambios epigenéticos específicos que caracterizan el tumor de un individuo, los tratamientos se pueden adaptar para abordar esos cambios, lo que podría conducir a terapias más efectivas y menos tóxicas. Por ejemplo:
Esto podría usarse para guiar la selección de fármacos epigenéticos. Si un tumor tiene una alteración epigenética específica, se podría elegir un fármaco dirigido a esa alteración.
Los marcadores epigenéticos podrían ayudar a predecir qué pacientes es probable que respondan a ciertos tratamientos. Por ejemplo, ciertos patrones de metilación pueden predecir la respuesta a los inhibidores de la ADN metiltransferasa.
Las terapias epigenéticas podrían usarse en combinación con otros tratamientos, como la quimioterapia tradicional o la inmunoterapia, para aumentar su eficacia.
La testosterona ejerce sus efectos uniéndose a los receptores de andrógenos, que se encuentran en varios tejidos del cuerpo. Este complejo receptor-hormona luego ingresa al núcleo de la célula y se une a regiones específicas del ADN, llamadas elementos sensibles a los andrógenos (ARE, por sus siglas en inglés). Esta unión regula la transcripción de genes específicos, alterando la producción de proteínas dentro de la célula. Este proceso se conoce como acción genómica.
Los efectos de la testosterona pueden ser directos, lo que significa que se une a los receptores de andrógenos, o indirectos, a través de su conversión en otras hormonas. Por ejemplo, la testosterona puede convertirse en dihidrotestosterona (DHT) mediante la enzima 5-alfa reductasa. DHT es un andrógeno más potente y juega un papel importante en ciertos tejidos como la próstata y los folículos pilosos. Alternativamente, la testosterona también se puede convertir en estradiol, una forma de estrógeno, por la enzima aromatasa. Este proceso es particularmente importante en la salud ósea.
Además de estas acciones genómicas, la testosterona también puede ejercer acciones no genómicas, que son más rápidas y no implican cambios en la transcripción de genes. Estos incluyen la modulación de las vías de señalización celular y los canales iónicos, lo que lleva a cambios inmediatos en la función celular.
Esta combinación de acciones genómicas y no genómicas permite que la testosterona influya en una amplia gama de procesos fisiológicos, lo que afecta el crecimiento muscular, la distribución de grasa, la salud ósea, la salud cardiovascular, la salud metabólica y más.
La genética se refiere al estudio de los genes, su herencia y su papel en los rasgos físicos y funcionales de un organismo. La epigenética, por otro lado, estudia los cambios en los organismos causados por la modificación de la expresión génica en lugar de la alteración del código genético en sí. Esencialmente, mientras que la genética se trata de la secuencia de ADN, la epigenética se trata de cómo se activan y desactivan los genes.
Los cambios epigenéticos pueden contribuir al desarrollo del cáncer al desactivar genes supresores de tumores o activar oncogenes. Cuando los genes que regulan el crecimiento y la división celular se ven afectados, puede conducir a la proliferación celular descontrolada característica del cáncer.
Sí, el estilo de vida y los factores ambientales pueden influir en los cambios epigenéticos relacionados con el cáncer. Por ejemplo, fumar y el consumo de alcohol pueden inducir cambios en la metilación del ADN, mientras que una dieta equilibrada y el ejercicio regular pueden ayudar a mantener una regulación epigenética normal.
Los cambios genéticos se refieren a alteraciones en la secuencia de ADN, como mutaciones, que pueden transmitirse de generación en generación. Los cambios epigenéticos, por otro lado, no alteran la secuencia de ADN subyacente, sino que modifican los patrones de expresión génica a través de mecanismos como la metilación del ADN, la modificación de histonas y los ARN no codificantes.
La metilación del ADN y la modificación de histonas son dos procesos epigenéticos clave. La metilación del ADN normalmente reprime la expresión génica al agregar grupos metilo al ADN, mientras que la modificación de las histonas altera la estructura del ADN, haciéndolo más o menos accesible para la transcripción. Ambos procesos son cruciales para controlar cuándo y cómo se expresan los genes.
Sí, los cambios epigenéticos se pueden usar como biomarcadores para la detección temprana del cáncer. Cambios como patrones anormales de metilación del ADN o niveles alterados de ARN no codificantes pueden indicar la presencia de ciertos tipos de cáncer, incluso en etapas tempranas.
La principal ventaja de utilizar biomarcadores epigenéticos para la detección del cáncer es la posibilidad de un diagnóstico precoz. Sin embargo, las limitaciones incluyen el hecho de que algunos cambios epigenéticos pueden verse en diferentes enfermedades o incluso en individuos sanos, lo que puede complicar la interpretación. Además, las técnicas de estandarización para detectar estos cambios pueden ser un desafío.
La terapia epigenética tiene como objetivo reprogramar las células cancerosas al revertir las marcas epigenéticas anormales, restaurando así el control normal de la expresión génica. Se dirige a la naturaleza reversible de los cambios epigenéticos, ofreciendo una nueva vía para el tratamiento del cáncer.
Se han aprobado varios medicamentos epigenéticos para el tratamiento del cáncer, incluidos los inhibidores de la ADN metiltransferasa, como la azacitidina y la decitabina, y los inhibidores de la histona desacetilasa, como el vorinostat y la romidepsina.
Los beneficios potenciales de la terapia epigenética para el cáncer incluyen el tratamiento dirigido y el potencial para restaurar la expresión génica normal. Sin embargo, los desafíos incluyen posibles efectos secundarios, el riesgo de que las células cancerosas se vuelvan resistentes a los medicamentos epigenéticos y la naturaleza compleja del epigenoma.
Los avances recientes en el campo de la epigenética y el cáncer incluyen desarrollos en tecnologías de secuenciación, el advenimiento de la epigenómica unicelular y la introducción de la biopsia líquida, todo lo cual ha ampliado nuestra comprensión del papel de la epigenética en el cáncer.
La epigenética puede conducir a un tratamiento personalizado del cáncer al guiar la selección de medicamentos epigenéticos en función de las alteraciones epigenéticas específicas de un individuo. Los marcadores epigenéticos también podrían ayudar a predecir la respuesta al tratamiento y se pueden usar en combinación con otros tratamientos para aumentar su eficacia.
La comprensión de la epigenética puede ayudar a formar posibles estrategias de prevención contra el cáncer mediante la identificación de modificaciones en el estilo de vida que pueden prevenir o retrasar los cambios epigenéticos que conducen al cáncer. Esto podría implicar la promoción de hábitos de vida saludables, como una dieta equilibrada y ejercicio regular, que ayuden a mantener una regulación epigenética normal. Además, la detección regular de ciertos cambios epigenéticos en individuos en riesgo podría permitir una intervención más temprana y una prevención más efectiva.
Las perspectivas futuras en el campo de la epigenética en relación con el cáncer son prometedoras. A medida que nuestra comprensión se profundice, podemos esperar tratamientos más personalizados, mejores técnicas de detección temprana y estrategias de prevención efectivas basadas en la modificación del estilo de vida. Además, los avances como las tecnologías de secuenciación avanzada y las biopsias líquidas, junto con los avances en la epigenómica unicelular, están allanando el camino para la investigación y las aplicaciones innovadoras en este campo.
Loading...
Comparte este artículo en las redes sociales.
La concientización sobre el cáncer de piel es crucial para la detección temprana y la prevención de esta enfermedad prevalente. Como el tipo de cáncer más común en todo el mundo, afecta a millones de personas cada año. Una mayor conciencia conduce a una mejor comprensión de los factores de riesgo, las medidas de prevención y las señales de alerta temprana, lo que en última instancia salva vidas.
Para los hombres, mantener una buena salud de la próstata se vuelve más importante a medida que envejecen. Para las personas mayores de 30 años, es importante tomar medidas preventivas y estar atentos a los signos de detección temprana.
La salud de los senos es un aspecto esencial del bienestar general de una mujer. Como mujer de 30 años o más, es importante comprender los conceptos básicos de la salud de los senos, el papel de la dieta y el ejercicio, los métodos de detección temprana y cómo realizar autoexámenes. Esta guía integral le proporcionará el conocimiento que necesita para tomar decisiones informadas sobre la salud de sus senos y le permitirá tomar el control de su bienestar.
El mango es una deliciosa fruta tropical que no solo es deliciosa sino que también ofrece muchos beneficios para la salud. Los mangos son parte de la familia de los pistachos y los anacardos, conocida como la familia Anacardiaceae. El mango viene en muchas variedades diferentes, cada una con su propio sabor y textura únicos.
10 de diciembre de 2022
El hígado es un órgano importante del cuerpo que ayuda en la digestión, almacena nutrientes y desintoxica nuestro cuerpo al eliminar sustancias nocivas. El hígado también actúa como un importante guerrero de nuestro sistema inmunológico, ya que identifica bacterias, virus y toxinas dañinas que ingresan a nuestro cuerpo, las captura y las expulsa del cuerpo. Un hígado sano es esencial para la salud y el bienestar general.
10 de febrero de 2024
Imagine su cuerpo como una intrincada fortaleza, constantemente custodiada por un protector invisible pero siempre vigilante: el moco. Este héroe anónimo trabaja incansablemente, protegiéndote del ataque de los villanos ambientales y de la agitación interna. Sin embargo, cuando nos encontramos constantemente aclarándonos la garganta o luchando contra esa molesta sensación de flema, es una señal de que nuestro protector está trabajando horas extras. Esta no es sólo una historia de malestar; es una historia de resiliencia, una señal de nuestros cuerpos de que algo anda mal. Entendamos este mecanismo de protección, exploremos las innumerables causas de la flema y la mucosidad en la garganta y descubramos las formas en que podemos apoyar las defensas naturales de nuestro cuerpo para una vida más feliz y saludable.
10 de febrero de 2023
Imagine un futuro en el que los diagnósticos médicos se realicen con precisión y rapidez, y los planes de tratamiento se adapten al paciente individual. La inteligencia artificial está haciendo posible ese futuro.
15 de noviembre de 2022
La industria de la salud ha comenzado a adoptar el Internet de las cosas para la atención de los pacientes y el seguimiento de sus necesidades. El monitoreo remoto, los sensores inteligentes, la integración de dispositivos médicos, los rastreadores de actividad física, los sensores biométricos portátiles, los monitores de glucosa, los dispensadores de recetas y las camas inteligentes son ejemplos de la adopción de Internet de las cosas en el cuidado de la salud.
8 de noviembre de 2022
La tecnología Blockchain tiene el potencial de transformar la atención médica. La tecnología Blockchain se puede utilizar para construir un ecosistema de atención médica centrado en el paciente que sea seguro e interoperable.
10 de agosto de 2023
¿Estás listo para potenciar tus mañanas y establecer un tono saludable para el resto del día? A menudo se recomienda beber una mezcla de cúrcuma y jengibre a primera hora de la mañana por sus posibles beneficios para la salud. El consumo de estos dos juntos puede proporcionar beneficios sinérgicos al tiempo que mejora sus efectos individuales.
10 de enero de 2023
El ajo se ha utilizado durante siglos como un remedio natural para una variedad de condiciones médicas. Las propiedades beneficiosas del ajo se deben a un compuesto llamado alicina.
11 de febrero de 2024
En este artículo, exploraremos la ciencia detrás del potencial del vinagre de sidra de manzana para mejorar los esfuerzos de pérdida de peso. Desde estimular el metabolismo y reducir la acumulación de grasa hasta regular los niveles de azúcar en sangre y suprimir el apetito, aprenda cómo este remedio natural podría respaldar sus objetivos de salud y estado físico.
A todos nos encanta exprimir el jugo de un limón y saborear su pulpa interna, pero ¿sabías que la cáscara de un limón contiene una gran cantidad de vitaminas, minerales y poderosos compuestos bioactivos? Descubramos el secreto de la cáscara de limón, un tesoro escondido que supera a la pulpa de limón en concentración de nutrientes.
12 de septiembre de 2022
La hormona del crecimiento humano (HGH) es una hormona que promueve el crecimiento, la masa muscular y el metabolismo de las grasas. HGH es una hormona natural liberada en el cuerpo por la glándula pituitaria. Puede ser especialmente importante durante la pérdida de peso, la recuperación de lesiones y el entrenamiento deportivo. Las personas pueden tratar de aumentar su hormona de crecimiento de forma natural cambiando su dieta y estilo de vida.
11 de diciembre de 2023
Explora el mundo de los pepinos, donde cada bocado no es solo un crujido refrescante, ¡sino también un paso hacia una mejor salud! A menudo pasados por alto como un simple ingrediente de ensalada, los pepinos son una fuente inagotable de nutrientes que hacen maravillas en el cuerpo. Desde hidratar tu piel hasta mantener tu corazón sano, estos vegetales verdes están llenos de sorpresas.
Es posible que conozca los beneficios para la salud de la papaya, pero ¿sabe que las hojas verdes del árbol de papaya son una fuente inagotable de propiedades curativas que se han utilizado en la medicina tradicional durante siglos? Las hojas de papaya contienen una mezcla única de enzimas, vitaminas y antioxidantes. Desde aumentar los niveles de plaquetas en pacientes con dengue hasta aliviar los problemas gástricos, las hojas de papaya son una fuente inagotable de salud.
9 de mayo de 2025
¿Alguna vez te has preguntado qué hace que tu piel brille, tus articulaciones se muevan con suavidad o tu cabello se mantenga fuerte? La respuesta suele estar en dos poderosas proteínas: el colágeno y la gelatina. Aunque provienen de la misma fuente, funcionan de maneras diferentes, y conocer la diferencia puede transformar tu rutina de salud. Ya sea que busques mejorar tu belleza, sanar tu intestino o aliviar el dolor articular, comprender la diferencia entre el colágeno y la gelatina podría ser tu arma secreta.
Detrás de cada decisión que tomas, desde elegir un refrigerio hasta perseguir un sueño, hay una poderosa sustancia química en acción: la dopamina. Conocida a menudo como la sustancia química del bienestar, la dopamina no solo te hace feliz, sino que también te ayuda a guiar tus decisiones a diario. Exploremos el fascinante mundo de la dopamina y descubramos cómo influye en tu forma de pensar, actuar y elegir.
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
5 de abril de 2025
Cada respiración llena tu cuerpo de vida. Tus pulmones pueden obstruirse con toxinas como la contaminación, el humo y los alérgenos, lo que dificulta la respiración y te hace sentir lento. La buena noticia es que tus pulmones tienen una increíble capacidad para sanar y limpiarse a sí mismos. Si les brindas el apoyo adecuado, puedes desintoxicarlos de forma natural.
15 de marzo de 2025
Imagina si el secreto para una piel radiante y joven no estuviera en un frasco de cremas caras, ¡sino en lo más profundo de tu intestino! Sorprendente, ¿verdad? Investigaciones recientes demuestran que la salud intestinal podría ser la clave para aumentar la producción de colágeno, la proteína que mantiene la piel firme y radiante. Esta conexión intestino-piel, conocida como eje intestino-piel, revela cómo un intestino sano y equilibrado puede conducir a una piel más limpia. ¿Listo para descubrir cómo tu intestino y tu piel trabajan juntos para lograr ese brillo natural?
Muchos problemas de salud se deben a deficiencias de nutrientes. Tu cuerpo necesita una variedad de vitaminas y minerales para funcionar correctamente. Cuando no obtienes lo suficiente, puedes sentirte cansado, débil o incluso desarrollar problemas de salud graves. ¿Sabías que puedes solucionar la mayoría de las deficiencias con los alimentos adecuados? Exploremos las deficiencias más comunes y los sorprendentes alimentos que pueden ayudar.
16 de febrero de 2025
Los cálculos renales son dolorosos y pueden alterar la vida diaria. Estos depósitos minerales duros se forman en los riñones y pueden causar molestias graves al pasar por el tracto urinario. La buena noticia es que la dieta juega un papel clave en la prevención de los cálculos renales. Si come los alimentos adecuados y evita los perjudiciales, puede reducir el riesgo y mantener sus riñones sanos. Exploremos los mejores alimentos que ayudan a prevenir los cálculos renales y expliquemos por qué son beneficiosos.
9 de febrero de 2025
El momento adecuado juega un papel importante en la eficacia de una rutina de ejercicios. Algunas personas prefieren hacer ejercicio temprano por la mañana, mientras que otras se sienten más fuertes por la noche. Pero ¿existe realmente un mejor momento para hacer ejercicio?
31 de enero de 2025
La hipertensión arterial suele ser considerada el asesino silencioso, ya que aparece sin que nos demos cuenta y aumenta el riesgo de sufrir enfermedades cardíacas y accidentes cerebrovasculares. Pero hay buenas noticias: ¡puedes controlar tu salud simplemente eligiendo alimentos más inteligentes! Una dieta adecuada puede reducir de forma natural la presión arterial, mejorar la circulación y mantener tu corazón fuerte. Si te centras en alimentos ricos en nutrientes y reduces los perjudiciales, puedes crear una defensa poderosa contra la hipertensión.
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
El envejecimiento ha fascinado a los científicos durante siglos. Una de las teorías más conocidas es la teoría de los radicales libres del envejecimiento (FRTA, por sus siglas en inglés). Esta teoría sugiere que los radicales libres dañan las células con el tiempo, lo que conduce al envejecimiento y a las enfermedades. Durante décadas, los investigadores creyeron que los antioxidantes podrían ralentizar este proceso y prolongar la vida útil. Pero, ¿sigue siendo válida esta teoría hoy en día? Exploremos la teoría de la teoría de los radicales libres del envejecimiento, su auge, su declive y lo que sabemos ahora sobre el envejecimiento.
Bajar de peso puede ser un desafío, pero ¿sabías que tu cuerpo tiene un arma secreta? Se llama grasa parda. A diferencia de la grasa que queremos perder, la grasa parda te ayuda a quemar calorías. Funciona produciendo calor y acelerando tu metabolismo.
Cuando se trata de la salud intestinal, los probióticos y prebióticos suelen dominar la conversación. Sin embargo, un actor menos conocido pero igualmente importante merece reconocimiento: los postbióticos. Estos compuestos no son meros subproductos de la actividad probiótica; son agentes poderosos que contribuyen a la salud digestiva, la función inmunológica y mucho más. Prepárese para explorar qué son los postbióticos, sus beneficios únicos y formas prácticas de incorporarlos a su vida diaria.
6 de enero de 2025
El agua es fuente de vida, pero ¿la estás bebiendo de forma adecuada? Lo creas o no, puedes cometer errores con algo tan simple como beber agua. Si cometes estos errores, podrías estar perdiéndote los increíbles beneficios del agua para la salud. Peor aún, puede dañar tu cuerpo.
25 de diciembre de 2024
Las vacunas de ARNm se han convertido en un faro de esperanza en la lucha contra el cáncer. Estas terapias innovadoras aprovechan el poder del sistema inmunológico del cuerpo para atacar y destruir las células cancerosas. Si bien estas vacunas han ganado fama por combatir enfermedades infecciosas, su aplicación en oncología es un punto de inflexión.
23 de diciembre de 2024
El aceite de krill ha ganado una inmensa popularidad como suplemento para la salud gracias a sus increíbles beneficios para la salud. Extraído de unos diminutos crustáceos llamados krill, este aceite está repleto de nutrientes esenciales como ácidos grasos omega-3, fosfolípidos y astaxantina. Ya sea que desee mejorar la salud de su corazón o mejorar su piel, el aceite de krill ofrece numerosas ventajas.
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
14 de diciembre de 2024
El hígado es uno de los órganos más vitales del cuerpo, responsable de filtrar toxinas, producir bilis y regular el metabolismo. Un hígado que funcione bien es clave para la salud general. Si ha estado buscando la mejor desintoxicación del hígado, está en el lugar correcto. Descubramos cómo desintoxicar el hígado de forma natural y mejorar la salud hepática.
7 de diciembre de 2024
La relación entre los riñones y la presión arterial es un aspecto vital de la salud que muchas personas pasan por alto. Los riñones desempeñan un papel fundamental en el mantenimiento de una presión arterial saludable, mientras que la presión arterial alta puede afectar gravemente la función renal. Esta conexión forma un ciclo peligroso en el que una afección empeora la otra.
Las semillas de sésamo han sido un alimento básico en muchas cocinas durante siglos. Estas pequeñas semillas no solo son sabrosas, sino que también están repletas de nutrientes. Desde mejorar la salud del corazón hasta mejorar la piel y el cabello, las semillas de sésamo son un verdadero superalimento. Exploremos los beneficios para la salud de las semillas de sésamo, cómo usarlas y por qué merecen un lugar en su dieta diaria.
24 de noviembre de 2024
Los caquis, a menudo llamados la fruta de los dioses, son más que un dulce y vibrante manjar. Son una fuente inagotable de nutrición con increíbles beneficios para la salud. Desde mejorar la salud del corazón hasta darle a la piel un brillo radiante, esta deliciosa superfruta merece un lugar en tu dieta diaria. Repletos de antioxidantes, vitaminas y minerales, los caquis pueden transformar tu salud de maneras que nunca imaginaste.
14 de noviembre de 2024
El agua de coco, el líquido transparente que se encuentra dentro de los cocos jóvenes, es más que una bebida refrescante. Con su sabor ligeramente dulce y a nuez y su rico perfil de nutrientes, el agua de coco ha ganado popularidad por sus beneficios únicos para la salud. Repleta de electrolitos como potasio, magnesio y calcio, es una bebida ideal para la hidratación y el bienestar natural.
6 de noviembre de 2024
La avena es más que un alimento popular para el desayuno; sus beneficios son numerosos y diversos. La avena ha ganado reconocimiento por su excepcional perfil nutricional y su potencial para mejorar la salud en general. Exploremos los increíbles beneficios de la avena para la salud, incluido cómo puede mejorar la salud cardíaca, favorecer la digestión e incluso ayudar a controlar el peso. Si comprende la gama completa de beneficios de la avena, podrá ver por qué incorporar avena a su dieta es una opción inteligente.
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
El colágeno es una proteína clave en nuestro cuerpo que mantiene la piel firme, las articulaciones flexibles y los huesos fuertes. A medida que envejecemos, la producción de colágeno disminuye naturalmente, lo que provoca signos de envejecimiento como arrugas, líneas finas y flacidez de la piel. ¡Pero la buena noticia es que existen formas de aumentar la producción de colágeno de forma natural!
La inflamación es una de las principales causas del dolor y la rigidez de las articulaciones, en particular en quienes padecen artritis u otros problemas relacionados con ellas. Adoptar una dieta antiinflamatoria es una forma natural de controlar y reducir la inflamación, mejorar la flexibilidad y favorecer la salud general de las articulaciones. Algunos alimentos pueden combatir la inflamación y promover la flexibilidad de las articulaciones, mientras que otros pueden empeorarla. Veamos cuáles son los mejores alimentos que se deben incluir, los que se deben evitar y los hábitos de vida y los suplementos que pueden favorecer aún más la salud de las articulaciones.
17 de octubre de 2024
La fruta del dragón, también conocida como pitaya, es una fruta vibrante con muchos beneficios para la salud. Esta fruta tropical ha ganado popularidad en todo el mundo por su apariencia llamativa y su poderoso perfil nutricional. Exploremos los principales beneficios de la fruta del dragón y por qué debería considerar agregar esta superfruta a su dieta. Ya sea que prefiera la fruta del dragón roja o la variedad amarilla, la fruta del dragón ofrece algo para todos.
10 de octubre de 2024
El síndrome de fatiga crónica (SFC) es una enfermedad debilitante que se caracteriza por una fatiga persistente que no mejora con el descanso. Afecta a millones de personas en todo el mundo y puede afectar gravemente la vida diaria. Comprender las causas y las opciones de tratamiento es fundamental para quienes padecen fatiga crónica. Exploremos las causas comunes de la fatiga crónica, los alimentos que pueden ayudar a combatir el agotamiento crónico y los suplementos eficaces para mantener los niveles de energía. Al abordar estos factores, puede encontrar alivio de los síntomas del síndrome de fatiga crónica y descubrir posibles opciones de tratamiento para la fatiga crónica que funcionen para usted.
El IoT ofrece importantes beneficios para el manejo de enfermedades crónicas al permitir el monitoreo continuo de las métricas de salud de los pacientes. Con dispositivos como monitores de glucosa inteligentes y tensiómetros, los proveedores de atención médica pueden recibir datos en tiempo real. Esto permite intervenciones oportunas, planes de tratamiento personalizados y una mejor participación del paciente, lo que en última instancia conduce a mejores resultados de salud.
2 de octubre de 2024
La presión arterial alta, también conocida como hipertensión, afecta a millones de personas en todo el mundo. Si no se controla, puede causar graves problemas de salud. Pero hay buenas noticias: cambiar la dieta puede ayudar a reducir la presión arterial de forma natural. Conozcamos los principales alimentos que pueden marcar una gran diferencia a la hora de reducir la presión arterial alta de forma natural.
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
25 de septiembre de 2024
La enfermedad por reflujo gastroesofágico (ERGE) es una afección común que afecta a muchas personas en todo el mundo. Se produce cuando el ácido del estómago fluye con frecuencia hacia el esófago. Este reflujo, conocido como reflujo ácido, puede irritar el revestimiento del esófago y provocar diversos síntomas incómodos.
22 de septiembre de 2024
¿Sabías que el azúcar de tu dieta podría dañar tu piel en secreto? Aunque el azúcar puede ser algo delicioso, puede causar estragos en tu cutis. El azúcar no solo causa acné, sino que también acelera la aparición de arrugas y tiene un gran impacto en la salud de tu piel. Entendamos cómo afecta el azúcar a tu piel, cómo reducir el azúcar puede ser un remedio antienvejecimiento, y todo esto de forma natural.
31 de julio de 2024
La miel, una maravilla natural, no sirve sólo para endulzar el té; es un héroe poderoso y totalmente natural para el cuidado de la piel. Desde humectante y curativo hasta iluminador y antienvejecimiento, la miel ofrece muchos beneficios que pueden transformar su cutis.
29 de julio de 2024
Los círculos oscuros debajo de los ojos pueden hacerte lucir cansado y mayor de lo que te sientes, arrojando sombras sobre tu vibrante personalidad. Ya sea que se deban a noches de insomnio, factores genéticos o el estrés de la vida diaria, son un problema de belleza común.
28 de julio de 2024
Las infecciones del tracto urinario (ITU) son comunes, especialmente entre las mujeres, y pueden causar molestias y dolor importantes. Si bien es esencial consultar a un profesional de la salud en caso de infecciones urinarias graves o recurrentes, existen varios remedios caseros que pueden ayudar a aliviar los síntomas y apoyar el proceso de curación.
27 de julio de 2024
¿Estás superando tus límites en el gimnasio pero te sientes constantemente dolorido y fatigado? Alcanzar tus objetivos de acondicionamiento físico no se trata solo de levantar más peso o correr más rápido, sino también de qué tan bien te recuperas. La recuperación muscular eficaz puede aumentar su rendimiento, prevenir lesiones y garantizar que siempre esté listo para afrontar su próximo entrenamiento.
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
26 de julio de 2024
El aceite de menta, derivado de la planta de menta, ha sido un remedio muy apreciado en la medicina tradicional durante siglos. Su componente principal, el mentol, es el secreto detrás de muchos de sus poderosos beneficios para la salud.
25 de julio de 2024
La melatonina es una hormona que ayuda a regular el ciclo de sueño-vigilia. A menudo se toma como un suplemento para ayudar a dormir, pero muchas personas informan que experimentan sueños vívidos o inusuales mientras lo toman.
24 de julio de 2024
La enfermedad de Alzheimer y la fatiga muscular pueden parecer afecciones no relacionadas a primera vista, pero las investigaciones emergentes sugieren un vínculo sorprendente entre ellas: la inflamación. Comprender esta conexión podría allanar el camino para nuevos enfoques de tratamiento y mejorar la calidad de vida de los afectados.
24 de julio de 2024
Cuando se trata de la salud del corazón, la pequeña tableta de aspirina podría ser una de las amigas más poderosas de su botiquín. Conocida desde hace mucho tiempo por su capacidad para aliviar dolores y molestias, la aspirina también desempeña un papel crucial en la protección del corazón. Descubramos cómo este medicamento cotidiano podría cambiar las reglas del juego para su bienestar cardiovascular.
23 de julio de 2024
Las biopsias líquidas representan un avance revolucionario en la detección y seguimiento del cáncer. Al analizar pequeños fragmentos de ADN y otros biomarcadores en la sangre, las biopsias líquidas ofrecen una visión no invasiva y en tiempo real de la presencia y progresión del cáncer. Este método revolucionario promete no sólo una detección más temprana sino también un enfoque de tratamiento más personalizado.
23 de julio de 2024
El aceite de eucalipto es un aceite aromático bastante versátil que ofrece varios beneficios. Ya sea que esté buscando respirar mejor, aliviar el dolor o simplemente mejorar su estado de ánimo, el aceite de eucalipto ofrece varios beneficios que pueden transformar su rutina diaria.
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
23 de julio de 2024
Vicks VapoRub es un ungüento tópico popular que se ha utilizado durante generaciones para aliviar diversas dolencias. Este ungüento multiusos no es sólo para calmar los resfriados y la tos; Es un remedio versátil que puede aliviar los dolores musculares, aliviar los dolores de cabeza e incluso abordar problemas de la piel.
22 de julio de 2024
El manejo de enfermedades crónicas es un área crítica de la atención médica que requiere atención continua, participación del paciente y uso eficaz de los recursos. La integración de la IA con el toque humano puede revolucionar este campo al brindar una atención personalizada y eficiente.
22 de julio de 2024
Desde prevenir fracturas dolorosas hasta prevenir la osteoporosis, comprender y mantener la densidad ósea es clave para mantenerse vibrante y móvil a medida que envejece. Una alta densidad ósea es esencial para una vida sana y activa.
En la lucha contra el cáncer, la quimioterapia tradicional ha sido durante mucho tiempo la piedra angular del tratamiento. Sin embargo, a medida que avanza la ciencia, está surgiendo una nueva era de terapias no invasivas que ofrece alternativas prometedoras que podrían transformar la atención del cáncer.
21 de julio de 2024
Imagínese abordar ese dolor de espalda persistente o ese dolor de cabeza persistente no con drogas sintéticas, sino con remedios poderosos y probados que se encuentran en su propia cocina o jardín. Ya sea que esté buscando una alternativa natural para aliviar el dolor o simplemente tenga curiosidad por el bienestar integral, estos remedios podrían ser su solución.
Imaginemos un futuro en el que el envejecimiento no sea sólo un lento declive, sino un proceso que podamos controlar y retrasar activamente. Imagine un mundo en el que nuestros cuerpos se mantengan jóvenes y flexibles, no sólo por casualidad, sino gracias a la ciencia de vanguardia. Los científicos están descubriendo el misterio de cómo la inhibición de proteínas podría revolucionar nuestra comprensión del envejecimiento. Al atacar proteínas específicas que inducen daño y degradación celular, es posible que podamos detener el reloj biológico.
Manténgase informado sobre salud y bienestar
Obtenga acceso a la cobertura de la industria galardonada, que incluye las últimas noticias, estudios de casos y asesoramiento de expertos.
Suscríbete al canal de Youtube de Webmedy para ver los videos más recientes
Donar
¡Su generosa donación hace una gran diferencia!
Loading...

Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Loading...
Manténgase informado sobre salud y bienestar
Obtenga acceso a la cobertura de la industria galardonada, que incluye las últimas noticias, estudios de casos y asesoramiento de expertos.
Suscríbete al canal de Youtube de Webmedy para ver los videos más recientes
Donar
¡Su generosa donación hace una gran diferencia!
Loading...
Wakening Wholesome Wellness™
Suscríbete al canal de Youtube de Webmedy para ver los videos más recientes